Đăng ký thuốc lưu hành tại Việt Nam luôn là vấn đề được doanh nghiệp quan tâm để có số đăng ký sản xuất.
Bởi vì thuốc được đăng ký lưu hành liên quan trực tiếp đến sức khỏe con người và những vấn đề phức tạp về pháp lý cũng như kỹ thuật liên quan đến đăng ký lưu hành thuốc mà các cơ quan quản lý dược ở Việt Nam và trên thế giới đều phải đối mặt.
Doanh nghiệp dược khi nộp hồ sơ đăng ký thuốc cho cơ quan quản lý đều muốn biết tình trạng hồ sơ của mình. Nhà nước luôn có chủ trương xây dựng Chính phủ kiến tạo.
Trong nhiều năm qua, Bộ Y tế, Cục Quản lý Dược đã nỗ lực đưa ra nhiều giải pháp nâng cao năng lực giải quyết đăng ký thuốc để đảm bảo người dân tiếp cận nhanh nhất với thuốc có chất lượng, an toàn, hiệu quả và hỗ trợ doanh nghiệp dược phẩm trong nghiên cứu, sản xuất, đăng ký lưu hành thuốc.
 |
| Cục Quản lý Dược đã có những giải pháp cải tiến, minh bạch trong việc đăng ký hồ sơ lưu hành thuốc. (Ảnh minh họa: Thông tấn xã Việt Nam). |
Trong công tác quản lý đăng ký thuốc, có những giai đoạn Cục Quản lý Dược phải đối mặt với những thách thức cả yêu cầu về kỹ thuật hồ sơ đăng ký thuốc tăng lên theo hòa hợp ASEAN và khối lượng hồ sơ đăng ký thuốc của các doanh nghiệp dược phẩm tăng đột biến.
Điển hình như cuối năm 2009, thời điểm bắt buộc áp dụng bộ hồ sơ kỹ thuật chung ASEAN, Bộ Y tế ban hành Thông tư số 22/2009/TT-BYT ngày 24/11/2009 quy định việc đăng ký thuốc.
Tháng 11 năm 2014, Bộ Y tế ban hành Thông tư số 44/2014/TT-BYT thay thế Thông tư số 22/2009/TT-BYT nêu trên với một số yêu cầu về pháp lý, kỹ thuật phù hợp với yêu cầu mới về đăng ký thuốc.
Năm 2016, Luật Dược mới được Quốc Hội thông qua, kèm theo đó Bộ Y tế phải xây dựng các văn bản quy phạm pháp luật liên quan cho phù hợp với Luật Dược năm 2016, trong đó có Thông tư quy định Đăng ký thuốc.
Trước các thời điểm văn bản quy phạm pháp luật mới được ban hành, các doanh nghiệp dược phẩm có xu hướng “tăng tốc” đăng ký lưu hành thuốc để được áp dụng quy định cũ.
|
|
Do đó, số lượng hồ sơ đăng ký thuốc nộp tại Cục Quản lý Dược tăng đột biến.
Cục Quản lý Dược đã cố gắng giải quyết công việc.
Tuy nhiên, còn gặp nhiều khó khăn trong việc giải quyết hồ sơ đăng ký thuốc, chưa đáp ứng được yêu cầu của doanh nghiệp, số hồ sơ đưa ra thẩm định chưa kịp so với số hồ sơ nhận vào, cải cách chưa theo kịp với yêu cầu, kịp thời thông tin giải quyết hồ sơ đăng ký thuốc.
Doanh nghiệp còn chưa hài lòng, dư luận còn có các ý kiến trái chiều với Cục Quản lý Dược.
Những khó khăn trên do nhiều nguyên nhân như Cục Quản lý Dược còn thiếu nguồn nhân lực cả về số lượng và trình độ để bắt kịp với yêu cầu mới trong công tác quản lý nói chung, thiếu nguồn chuyên gia chuyên trách có đủ trình độ và kinh nghiệm thẩm định hồ sơ đăng ký thuốc.
Cục Quản lý Dược đã mời các chuyên gia từ nhiều nguồn như Trường Đại học Y Dược, các bệnh viện, viện nghiên cứu tại Hà Nội và thành phố Hồ Chí Minh.
Các chuyên gia làm việc theo chế độ kiêm nhiệm nên không đảm bảo 100% tiến độ thời gian thẩm định theo yêu cầu.
Việc thẩm định hồ sơ đăng ký thuốc còn phụ thuộc nhiều vào chuyên gia công tác bên ngoài Cục Quản lý Dược.
Một nguyên nhân khác về khó khăn cho công tác đăng ký thuốc cũng phải kể đến là các doanh nghiệp chưa cập nhật và theo kịp với yêu cầu ngày càng chặt chẽ của hồ sơ đăng ký thuốc đối với vấn đề pháp lý và kỹ thuật.
Do vậy, chất lượng hồ sơ đăng ký thuốc của các doanh nghiệp còn nhiều hạn chế dẫn đến phải bổ sung hồ sơ nhiều lần, dẫn đến thời gian đăng ký thuốc kéo dài.
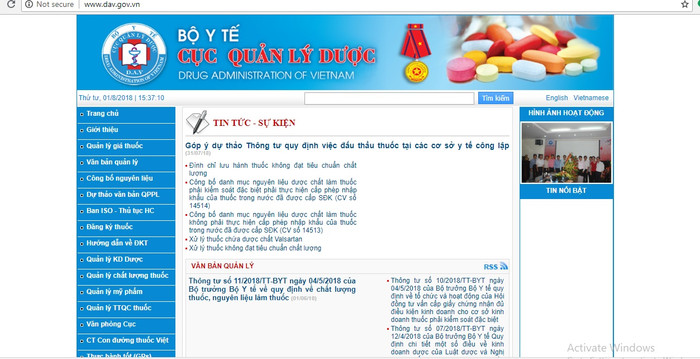 |
| Cục Quản lý Dược sẽ công khai, minh bạch thông tin giải quyết hồ sơ đăng ký thuốc trên trang web của Cục. |
Với chủ trương Chính phủ kiến tạo, Bộ Y tế, Cục Quản lý Dược trong năm 2017 đã đưa ra nhiều giải pháp, nhưng cũng xác định còn nhiều vất vả, mất thời gian để có thể đáp ứng tốt nhất yêu cầu của Chính phủ, doanh nghiệp và dư luận đối với giải quyết hồ sơ đăng ký thuốc.
Trong thời gian qua cũng như sắp tới, Bộ Y tế, Cục Quản lý Dược thực hiện chủ động một số giải pháp như:
Nhanh chóng đưa hồ sơ đăng ký thuốc ra thẩm định nhằm giảm thời gian “chờ” của hồ sơ;
Tăng cường số lượng, chất lượng chuyên gia thẩm định hồ sơ đăng ký thuốc nhằm giảm thời gian thẩm định, nâng cao chất lượng thẩm định;
Tăng cường số lượng và chất lượng cán bộ của Cục Quản lý Dược trong các công đoạn của quy trình đăng ký thuốc nhằm chuyên môn hóa và rút ngắn thời gian xử lý hành chính của hồ sơ đăng ký thuốc;
Tăng cường cơ sở vật chất, sử dụng công nghệ thông tin nhằm thuận tiện hơn trong xử lý, tìm kiếm, tra cứu thông tin đăng ký thuốc.
Riêng đối với việc tiếp tục công khai, minh bạch thông tin trong giải quyết hồ sơ đăng ký thuốc, với chỉ đạo của lãnh đạo Bộ Y tế, Cục Quản lý Dược có những cải tiến đáng kể.
Trước đây, thông tin giải quyết hồ sơ đăng ký thuốc được lưu trữ và cập nhật tại các máy tính đặt tại “Bộ phận một cửa” của Cục Quản lý Dược.
Các doanh nghiệp muốn tra cứu phải đến trực tiếp để tra cứu thông tin, chưa thuận lợi.
Thông tin tra cứu còn hạn chế chưa đầy đủ như chỉ có mã hồ sơ, tên thuốc, công ty đăng ký, tuần thẩm định, tiến độ thẩm định (đang thẩm định hoặc chưa thẩm định), công văn bổ sung.
Từ tháng 11 năm 2017, Cục Quản lý Dược sẽ công khai, minh bạch thông tin giải quyết hồ sơ đăng ký thuốc trên trang web của Cục tại địa chỉ www.dav.gov.vn.
Nội dung thông tin đầy đủ hơn như mã hồ sơ, tên công ty đăng ký, tên công ty sản xuất, tên thuốc, loại thuốc, loại hồ sơ, ngày tiếp nhận hồ sơ, ngày đưa ra thẩm định, tiến độ thẩm định, lần thẩm định, ngày trả lời kết quả thẩm định.
Để thuận tiện tra cứu cho doanh nghiệp, các thông tin trên sẽ được định dạng tệp excel, cập nhật thông tin hàng tuần.
Với chủ trương, giải pháp cải tiến, minh bạch thông tin về đăng ký thuốc Cục Quản lý Dược hy vọng sẽ đáp ứng từng bước nhu cầu của doanh nghiệp và xã hội.